由嵌合的siRNA和YBC组成的创新核酸药物的开发
4月20日,庆应义塾大学宣布它已成功开发出一种候选核酸药物,该药物由高度序列特异性的 "嵌合式siRNA "和 "Y形块状共聚物"(YBC)组成,前者针对转录因子PRDM14基因,该基因在乳腺癌和胰腺癌中呈上调状态,后者将核酸输送到病变部位。 此外,一项针对复发性乳腺癌患者的由医生主导的临床试验(第一阶段)目前正在进行中。 该研究由东京大学医学部临床研究促进中心特聘副教授Hiroaki Taniguchi博士、大阪大学医学研究生院客座教授Yukikazu Natori博士、神奈川癌症中心临床研究所主任Yohei Miyagi博士、纳米医学创新中心研究科学家Kotaro Hayashi博士进行。 神奈川癌症中心临床研究所所长宫城洋平博士,纳米医学创新中心研究员林小太郎博士,东京大学医学科学研究所教授长村文孝博士,纳米医学创新中心主任片冈和则博士(东京大学名誉教授),以及北海道大学基因调控研究所客座教授今井幸三博士。 该研究结果已发表在《国际癌症杂志》上。
札幌医科大学的Minoru Toyoda(已故)和他的同事发现,PRDM14分子的表达在乳腺癌中特别高。 由于PRDM14只在癌症组织中表达,而不在正常细胞中表达,因此它有望成为癌症治疗的一个良好的分子目标。 由于PRDM14只在癌症组织中表达,而不在正常细胞中表达,因此它被认为是癌症治疗的一个很好的分子靶点。
由于PRDM14分子是一种核转录因子,研究小组启动了核酸药物发现,在这种情况下,基于基因信息的药物发现是可能的。 目标是为不能接受治愈性切除的病人创造一种使用静脉给药的系统性给药方法。 为了克服核酸药物发现中的障碍,我们研究了核酸及其输送系统的创新技术的应用。 具体来说,我们使用了东京大学理科研究生院开发的嵌合siRNA,它在血液中极为安全和稳定,能提供足够的RNA干扰效果,并根据siRNA序列搜索程序选择了消除脱靶效应的治疗序列。 此外,我们决定使用YBC,一种由东京大学工程研究生院和纳米医学创新中心开发的核酸纳米载体,因为YBC是由聚鸟氨酸和聚乙二醇(PEG)组成的,对其原料的安全性没有顾虑,显示出良好的血液保留,并且由于其EPR效应,在癌症组织中有很高的积累。 通过EPR效应,它在癌症组织中显示出良好的血液保留和高积累。
抑制小鼠模型的肿瘤直径增大,延长远处转移模型的生存期
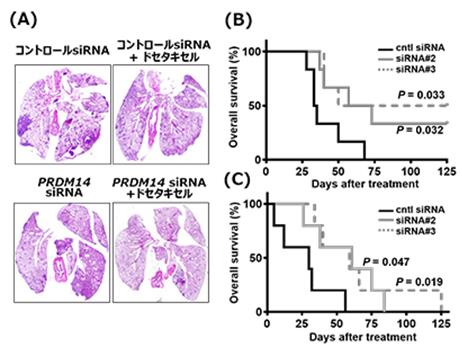
为了评估PRDM14 siRNA核酸候选药物的疗效,我们利用从难治性三阴性乳腺癌和胰腺癌建立的PRDM14分子阳性的癌症细胞系建立了一个动物模型。 静脉给药可抑制乳腺癌正位移植模型和胰腺癌皮下移植模型中肿瘤体积的增大,与抗癌药物联合使用时显示出协同的治疗效果。 此外,当应用于远处转移模型时,观察到转移数量的减少和生存期的延长。
此外,与YBC的前身支链PEG-聚(L-鸟氨酸)相比,使用支链PEG-聚(L-赖氨酸)被发现可以用较少的聚合物提供相同的治疗效果。
一项针对复发性乳腺癌患者的P1研究正在进行
由于在安全性研究(非临床研究)中没有观察到严重的不良事件,从2020年9月开始,在癌症研究所医院进行了一项由研究者发起的核酸候选药物的I期临床试验,用于治疗不能治愈性切除或有远处转移的复发性乳腺癌患者。






请您简单描述您正面临的问题和您的需求,并留下您的联系方式;
我们会为您匹配专门的医学顾问与您联系,帮你制定合适的方案。
在您提交相关的信息后,我们将会由专业的医学团队帮您规划合适的出国看病方案并进行费用预估。